第六章.气体分子运动论
初学者在掌握了牛顿力学的基本原理后,进入本章分子物理学和热力学的学习,往往对于直接利用牛顿力学来理解分子运动的内容,还能比较好地掌握,但对于与分子运动图象对应的宏观唯象概念就不能很透彻地理解了。实际上本课程之所以从分子运动论开始入手,再学习下章的热力学,就是希望读者能够建立起宏观现象和微观机制的这种对应,从而能够领会到把牛顿力学的一般原理应用到有关物性的复杂现象的威力。
牛顿力学的辉煌胜利并不只是局限于对天体运动和宏观物体的运动现象的研究上,只要从物质都是由分子组成的这么一个简单观念出发,就能很成功的把牛顿运动定律应用于我们对复杂的有关物性方面的研究。
平衡状态。
首先从我们的直观出发,与物态的变化相对的是物态的保持某种稳定,非常类似于我们从物体的运动中,领会到静止或匀速直线运动状态的特殊性,我们也可以设想物态的保持某种稳定性也会是非常有意义的。
那么,所谓物态保持稳定的具体含义又是什么呢?人们从大量的日常经验和科学实验中抽象出很多用来表征物体或物体系统的状态的量,例如压强,体积,化学组分等第,被称为状态参量,那么当一个系统的所有状态参量都保持不变时,我们就说系统处于平衡态。
反过来,当我们把一个系统从它的环境中抽象出来,就可以考虑这个系统在不受外界环境的影响下的状态,在实际的现象中,我们常常能观察到,经过一定的时间后,这个系统的各方面的宏观性质就不再随时间而发生变化,这是我们就可以称这个系统处于平衡态,而这时表征系统的各个方面的性质的确定的物理量,就称为状态参量。
在上面的叙述中,给人的感觉总是不那么明确,而同学们也正是因此而难以象接受时间和空间的概念一样,很快地能接受热力学的基本概念。问题的关键在哪里呢?就在于我们应该时刻牢记一点,那就是物理学本质上是一门实验科学,物理学的任何基本观念都直接来自于我们的客观经验。而我们的一种经验能否最终成为科学上的明确概念,就在于我们从经验里归纳出来的规律能否经受客观实验的检验。
那么我们在学习热力学时,就一定要做到“心中有物,物中有理”。学习理论的同时紧密的联系我们观察到的实际现象,特别是对于自学者来说,没有很多做实验的机会,就更应该加强自己在理论联系实际这方面的意识。这样才有可能真正学好物理学。
当然我们不可能孤立地研究一个一个的平衡态,相反,我们所要研究的主要还是系统在不同的平衡态之间发生变化时所表现的规律。在热力学里,为了方便的缘故,我们规定一种特定的平衡态之间的转变过程,即在不同平衡态之间的转变过程中的每一个时刻,系统所处的状态都无限地接近于一个平衡态,这种过程称为准静态过程。
当然,准静态过程实际上是不存在的,属于我们的一种理想实验,但我们关心的并不是在这个过程中的气体的状态,而是经过这个过程以后,系统所达到的状态,而系统所经过的状态的历史对于目前所处的状态并没有影响,因此我们假设系统在发生平衡态之间的转变时,是经过了一个准静态过程,并不影响我们对于平衡态下的系统的研究,同时我们针对平衡态所建立的概念还能运用于转变过程,从而简化了我们所要研究的物体状态变化的规律,而同时又没有丢失重要的物理内容。请同学们注意,这里实际上体现了非常重要的物理思想。
其实对于平衡态,我们还有一个更直观的感受,那就是温度,一个系统的温度处处都一样了,这个系统也就稳定下来了。可是温度在日常生活中的含义并不是很明确的。那么我们为什么不直接根据平衡态来定义温度呢?
在物理学中,我们正是这么做的。
首先我们给出热力学第零定律,这条定律反映的实际上是我们在观察热现象时所发现的一条最基本的规律:
当两个热力学系统中的每一个都和第三个热力学系统保持热平衡,那么这两个热力学系统也一定是保持热平衡的。
这里所谓的热平衡,指的是如果不对两个热力学系统隔绝热的相互作用,而这两个系统还保持各自的宏观性质,并不随时间而发生变化。
注意这条定律的叙述方式,实际上是描述了一个实验过程,而且这是一个非常一般,非常简明的实验过程,在这里,我们所说的全部其实就是,只要你做这样一个实验,无论具体如何实现这个实验,那么一定会得到定律所断言的结论。
而这个实验的操作过程,实际上就是给出了温度概念的一个明确定义。
当两个热力学系统中的每一个都和第三个热力学系统保持热平衡,那么这两个热力学系统就具有相同的温度。
正好和我们可以直接通过说明如何测量时间和空间,来定义时间和空间一样。
当然我们还需要规定温度的单位,从而能进行定量的测量。这就是我们下面要通过理想气体状态的变化来讨论的温标。
理想气体状态方程。
上面我们确立了研究热现象的概念基础后,就还是回到具体的问题中去,在对具体的物理对象的研究中进一步发展理论。
自然界最简单的物质形态就是气体。而对于气体,我们又抽象出一个最简单的物理模型,在这种抽象中,只要我们没有丢失系统的热力学基本性质,那么我们就能得到具有一般性意义的物理结果。我们学习物理,正是要学习到这种进行抽象的艺术。这种抽象能力,实际上决定了我们解决实际问题的能力。正如我们在后面讨论真实气体时所体会到的,实际问题往往是表象繁复,而决定性的物理因素又被这种繁复所掩盖,这时就只有依靠我们从中抽象出关键物理过程的能力了。
理想气体状态方程来源于Boyle定律。而Boyle定律是直接从大量的实验中总结出来的。
当一定质量的气体的温度保持不变时,其压强和体积的乘积总是一个常数:
pV=C。
这条定律与气体的种类是无关的,并且对压强和温度的大小都是有限制的。也就是说这是一个近似公式,在压强越小,温度越低的情况下,这个公式越接近实际情况。
同学们从牛顿力学进入热力学的学习,有一个很大的不适应,就是印象中牛顿力学里的基本方程都是绝对精确的,计算题里的结果也是绝对精确的,有误差的话,也是因为实验测量自身误差缘故。而热力学里连最初的公式都是近似公式,那怎么能相信后面的定律是可靠的了?
实际上这里存在一个很大的误解,就是牛顿力学的基本运动定律,固然也是来源于人们对实际运动的测量,而且所得到的运动定律,对于真实的物理运动本身,也同样还只是近似的。物理研究的关键不在于我们是否得到了最终的真理,而是在于根据我们的物理图象所得到的结论,是否在一定的范围内足够明确地反映了物理现象。
这里Boyle定律固然没有精确表述真实气体的性质,但后来人们给出的这背后的物理图象是反映了气体分子运动的基本属性的。因此这并不妨碍我们以此为基础,进一步研究气体的性质。
然后我们再考虑温度作为一个变量,对气体状态的影响。这里同样有相应的实验定律,总结起来,可以得到一个一般的气体状态方程。
即对于一定质量的气体,有
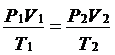 =常数。
=常数。
这里的常数与气体的种类无关,它所刻划的是气体作为一种物态的属性,因此我们可以选取一个标准的情形,比方说在标准状态下的一定气体的压强,体积,温度值,从而规定它的具体数值。进一步,扣除质量或者摩尔数的影响,可以得到一个普适的常数,即一摩尔的气体在标准状态下的pv/t的值称为摩尔气体常数。
这个一般的方程在实际情况中,还是要求一定的条件的,即要求气体的压强相比于大气压足够小,密度也足够小,而且越稀薄越精确,温度与室温相比也不能太低。
反过来我们可以把严格满足这个状态方程的气体定义为理想气体。而我们讨论分子运动论和热力学,也总是先从这样的理想气体出发。
注意我们这里对理想气体的定义,在后面还可以从分子运动论的角度来定义理想气体。最终我们可以得到这两种看法的一致性。
把这个方程用图形表示出来是非常有用的,由于状态方程包含了三个变量,因此为了避免作三维的立体图形,可以在固定一个变量的前提下,作另外两个变量的关系曲线,这样分别就可以作出等温线,等压线,等容线来,实际上这些种类的曲线也可以对应于实际的物理过程,例如玻意耳定理所描述的物理过程就可以用等温线刻划。
气体分子运动论的压强公式。
在推导理想气体分子的压强公式时,应用了非常重要的物理技巧,同学们一定要认真领会其中的方法。因为这是我们第一次来对宏观现象进行微观解释。
这里最重要的是一种思想方法,其次才是气体压强的微观含义。这种思想方法的核心就在于:
(1)从真实的气体抽象出一种理想的气体的微观模型,即理想气体的分子为自由而无规则运动的质点所组成。而且我们只讨论它的平衡态。
(2)气体分子的微观运动决定了气体的宏观表现。
(3)对于大量的分子运动,学会如何取平均和取单位量,从而在不丢失物理实质的前提下,得到简化的物理图象。
气体的压强是一个宏观观测量,只要我们仔细考虑一下测量压强的方法就可以找到如何从气体分子运动论的角度来理解它的物理含义。
对于确定状态的气体,要测量它的压强,必须应用一个表面来接触要研究的气体,通过气体对这个探测表面的作用来获得气体压强的数值。这也就是说,所谓气体的压强的产生,必须表现为气体分子对一个表面的作用,那么气体分子对一个表面的作用能是什么呢?只能是碰撞而已。
因此要探讨气体压强的具体的物理图象,我们不妨在气体中间假想一个表面,考虑气体分子对这个表面的作用就可以了。
这个探测表面的方便取法就是气体容器的器壁。那么我们如何规定对一个单位面积的器壁有作用的气体分子的范围呢?
这里就有重要的物理技巧。
首先从单个分子碰撞的角度出发,分子对器壁的碰撞的效果就是施加冲量,由单位时间内作用的单位面积的器壁上的冲量,就可以得到气体的压强。
即单个分子在一次碰撞中对器壁上单位面积dA的冲量为:
I=2mvix
那么单位时间内作用的单位面积的器壁上的冲量总和如何计算呢?这里有两个关键:
(1)单位时间内能够作用在单位面积器壁上的分子数目是有确定的体积的。
(2)近似地把分子的速度的分布取为一些离散的值,以便用简单的求和代替积分运算。
在计算总的冲量时,必须进行一些近似。
(1)在垂直于器壁的方向上,速度指向器壁的与背离器壁的分子数目一样,这是因为我们从宏观的角度来看,气体内部不存在宏观的定向流动。而这个条件的微观意义就应该是在垂直于器壁的方向上,速度指向器壁的与背离器壁的分子数目一样。
(2)对于大量分子来说,三个方向上的速度分量的平方的平均值相等。这同样是因为我们从宏观的角度来看,气体内部不存在宏观的定向流动。
可以看出来,这些假设其实是一致的,就是平衡态的概念。从这里我们就可以体会到平衡态的概念的重要地位。
由单位时间内作用在单位面积上的总的动量,就可以得到在这个单位时间内持续作用在单位面积上的力,也就是在这个单位时间内的的压强。而只要气体保持这个平衡态不变,这个压强也就不变。
写成公式,就是:
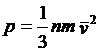
其中的1/3,表示我们所取的是分子运动的速度的三个分量中的一个,n是单位体积内的气体分子的数目,m是分子的质量,v是分子的运动速度。
如果定义分子运动的平均平动动能
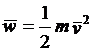
就可以把压强公式写成
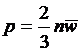
可以很直接地看出压强的微观分子运动的含义,并且反映了三个统计平均量的相互关系。注意这是一个统计规律,而不是一个力学规律。
从我们对压强的分子运动论的图象的理解,推导出了压强的基于分子运动的物理量的表达式,反过来从这个表达式我们可以体会到气体压强的对大量气体分子进行统计的物理意义。
气体分子平均平动动能与温度的关系。
上面我们得到的气体的压强公式实际上是一条宏观与微观之间的纽带,通过它我们还能解释作为一个宏观物理量的温度的微观含义。
我们稍微改变一下理想气体状态方程的形式,即把决定pv/t这个常数方法,由一定质量的气体与标准状态作比较,换成一定摩尔数的气体的比较,从而得到理想气体状态方程为
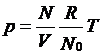
然后定义一个新的常数为摩尔气体常数除以阿伏伽德罗常数,称为玻尔兹曼常数k,因此又得到
p=nkT
与气体压强公式比较,就可以得到

可以看到,温度完全由气体分子运动的平均平动动能决定。也就是说,宏观测量的温度完全和微观的分子运动的平均平动动能相对应,或者说,大量分子的平均平动动能的统计表现就是温度(如果只考虑分子的平动的话)。
从上面的公式,我们还可以看到,如果已知气体的温度,就可以反过来求出处在这个温度下的分子的平动速度的平方的平均值,这个平均值开方就得到所谓方均根速率。
能量均分原理。理想气体的内能。
既然我们可以用分子运动的图象来研究气体,很自然,对于一个大量分子运动的系统,可以计算它的机械能,可以想象,这个机械能总和应该表现为宏观的气体的内能。
但是要计算分子系统的机械能总和,必须首先知道这个分子的运动系统里,包含什么样的运动形式,以及如何分别计算它们的能量。
一般说来,我们考虑分子的热运动,需要考虑分子的平动,转动,还有振动这几种运动形式。这里有一个基本原理,称为能量均分原理,这个原理来自于统计力学的基本假设,这里我们不作讨论,因此只是给出这个原理而不作更进一步的讨论。
这个原理断言,在平衡状态下,气体分子的每一个自由度所具有的能量都是![]() 。这样我们要计算一个系统的能量,只要计算出系统所有的自由度数目就可以了。
。这样我们要计算一个系统的能量,只要计算出系统所有的自由度数目就可以了。
另外,对于振动,如果考虑振动中的势能,则每一个振动自由度的能量是平动自由度的能量的两倍。
这样如果一个分子具有t个平动自由度,r个转动自由度,s个振动自由度,则大量这种分子的平均每个分子的平均总动能为:
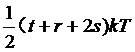
某种气体分子的内能与由这种分子的结构所决定的自由度数目相对应。并且完全由气体的温度决定。因此进一步我们得到了对应理想气体的另一种刻划,即内能完全由温度决定的气体为理想气体。
麦克斯韦分子速率分布定理。
前面我们对于平衡态下的气体的分子的运动进行统计计算时,回避了统计分布的问题。回顾一下我们在通过统计分子对器壁的碰撞运动来求出气体的压强表达式时,并不需要我们知道气体分子的速率的具体分布,那么这种分布究竟如何,特别是这种分布是否与温度具有某种关系呢?
麦克斯韦分子速率分布定理给出了答案:
在热力学温度为T的平衡状态下的给定气体中,分子速率分布在区间[v,![]() 之间的分子数百分率
之间的分子数百分率![]() 在
在![]() 很小时,等于
很小时,等于
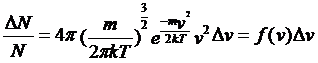
这里所定义的f(x)刻划了单位速率区间内的分子数目占总分子数目的百分比。因此称为配分函数,它满足归一化条件:
 。
。
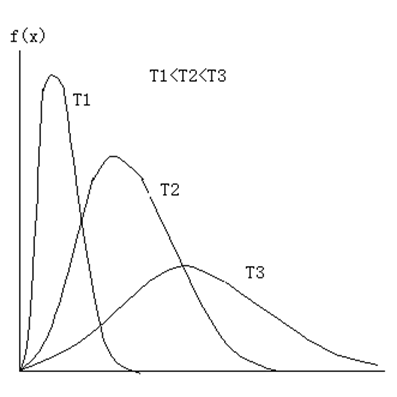
它的图形如下:
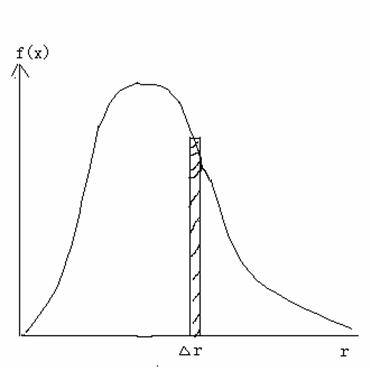
从这个曲线可以得到以下特征物理量:
曲线下面的面积就是相应速率区间的分子数目。
曲线的最大值称为最可几速率,表示在一定温度下,具有合这个速率相近的速率的分子所占的百分比最大。
对于不同的温度,配分函数的图形会有规律性的变化:温度越高,曲线的最大值越大,而曲线下面的面积需要保持恒定为1,因此曲线变得越平坦。如图所示:
分子碰撞和平均自由程。
我们再更详细的考虑一些分子的运动细节。
首先气体分子必须是相互碰撞的,否则一切有关气体的宏观现象都不可能发生,很显然,如果没有分子之间的相互碰撞,分子就会按照各自的初始速度作匀速直线运动(不考虑分子之间与外部的势场),那么就不会出现麦克斯韦分子速率分布现象,更不会有热的传递现象,总之一切热现象都谈不上了。
我们仍然以统计平均的思想来描述分子碰撞过程:
一个分子在相继的两次碰撞之间所自由经过的路程,称为自由程,对于大量分子,得到平均自由程。或者反过来,计算在单位时间内的一个分子的平均碰撞次数。
在分子的运动速率是遵循麦克斯韦分子速率分布定理的前提下,可以得到平均自由程的表达式:
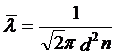
其中d为分子直径,n为分子数密度。
进一步可以得到:

即平均自由程和温度,压强的关系。
气体内的迁移现象及其基本定律。
实际上气体达到平衡态或者在不同的平衡态之间转换,都必须经过非平衡状态,前面我们已经讨论过准静态的概念,但那只是一种以研究平衡态为目的的,起辅助作用的理论模型,而我们感兴趣的大多数气体宏观现象都不是平衡态现象。
我们需要了解三种气体内的迁移现象:
(一)内摩擦现象。
当气体分层流动时,相对运动的两个气流层之间会产生相同大小而方向相反的摩擦力,称为内摩擦力。
实验表明,单位接触面积上的内摩擦力的大小和接触面的速度梯度成正比,写成表达式为
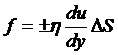
其中比例系数为内摩擦系数。
(二)热传导现象。
如果气体内部不同部分的温度不同,则会发生热量从高温处相低温处传递的现象,称为热传导现象。
实验表明,在单位时间内通过一个接触面的热量流量与接触面处的温度梯度成正比,与接触面面积成正比,写成表达式为:
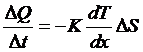
其中比例系数称为热传导系数。
(三)扩散现象。
由于气体种类或密度分布不均匀导致气体有规律的运动,从而在足够时间后,成分或密度分布趋向均匀的现象,称为扩散现象。
实验表明,在单位时间内,通过一个给定接触面积的扩散量的大小与接触面的密度梯度成正比,而与接触面积成正比,写成表达式为
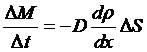
其中比例系数称为扩散系数。
对于这三种宏观现象,以及通过实验得到的定律,都可以在气体分子运动论的图象中得到解释。具体的微观分析非常复杂,超出了我们的要求。